Показания (одобрена употреба): През 2019 г. FDA го одобри за лечение на придобито, генерализирано разстройство на хипоактивното сексуално желание (HSDD) при жени в пременопауза, когато състоянието причинява значителен дискомфорт и не се дължи на други медицински/психиатрични състояния или странични ефекти от лекарството.
Механизъм на действие
PT-141 е агонист на меланокортиновите рецептори (предимно MC4 рецептор), който модулира сексуалното желание чрез пътища на централната нервна система.
За разлика от PDE5 инхибиторите (напр. силденафил), които засягат главно кръвоносните съдове, PT-141 действа централно, за да повлияе на сексуалната мотивация и възбуда.
Фармакология и дозиране
Приложение: Подкожно инжектиране, при необходимост (при поискване).
Одобрена доза: 1,75 mg s.c.
Фармакокинетика:
Tmax ≈ ~60 минути
t½ ≈ 2–3 часа
Ефектите могат да продължат няколко часа, в някои доклади до ~16 часа.
Клинична ефикасност (фаза III проучвания – RECONNECT, 24 седмици, рандомизирани контролирани проучвания)
Първични крайни точки:
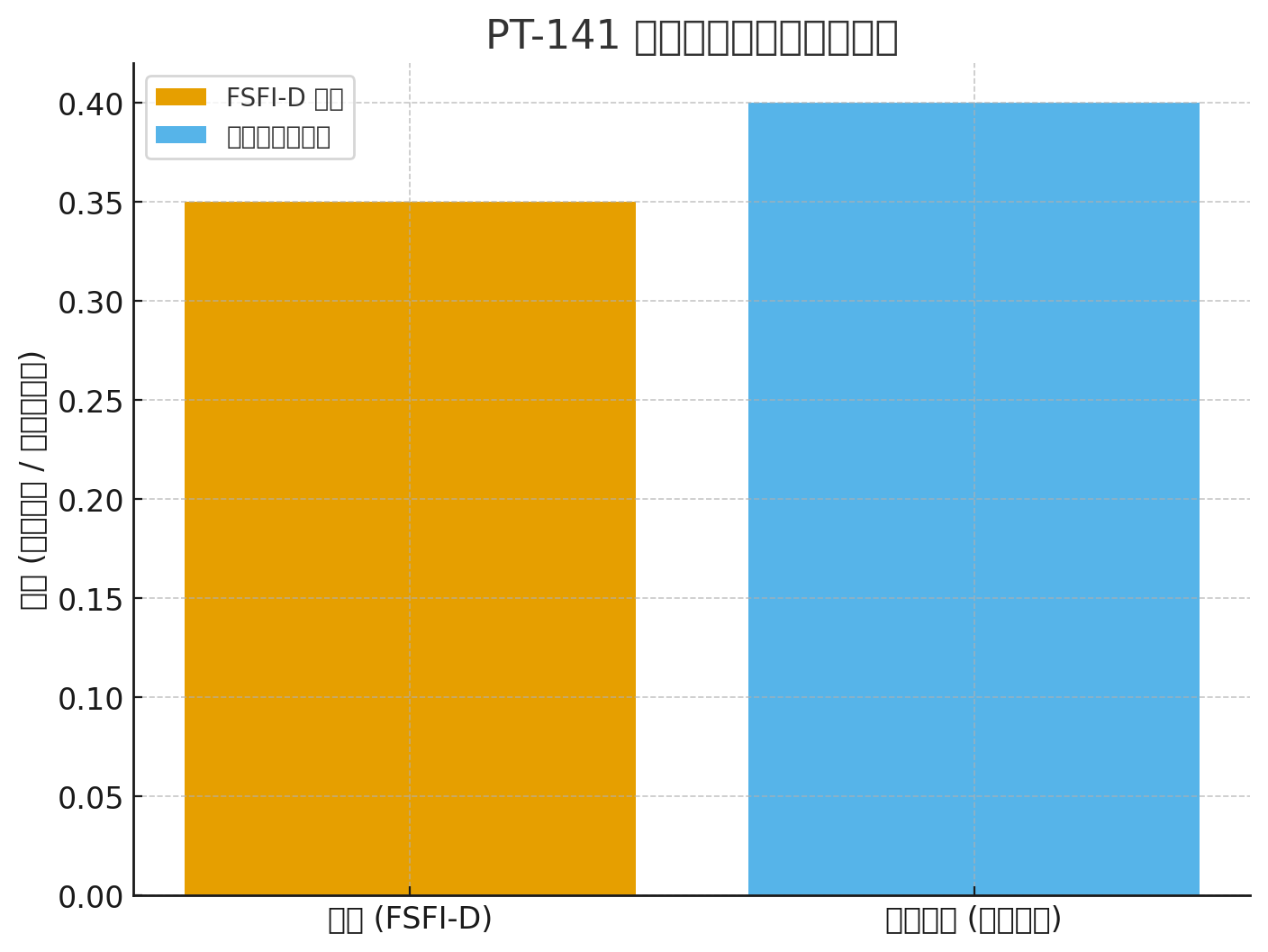
Индекс на женската сексуална функция – домейн на желанието (FSFI-D)
Скала за сексуален дистрес при жени (FSDS-DAO)
Ключови резултати (обединени проучвания 301 + 302):
Подобрение по FSFI-D: +0,35 спрямо плацебо (P<0,001)
Намаление на резултата по FSDS-DAO: −0,33 спрямо плацебо (P<0,001)
Други крайни точки: Подкрепящите резултати (оценки на сексуалната функция, удовлетвореност, съобщена от пациентите) са с положителна тенденция, но задоволителните сексуални събития (ЗСЗ) не винаги показват последователни значими разлики.
Нежелани събития (най-често съобщавани в проучванията)
Чести (≥10%):
Гадене (~30–40%; до ~40% съобщавани в проучвания)
Зачервяване (≥10%)
Главоболие (≥10%)
Сърдечно-съдови ефекти:
Наблюдавани са преходни повишения на кръвното налягане и промени в сърдечната честота, които обикновено отшумяват в рамките на няколко часа.
Противопоказан или се използва с повишено внимание при пациенти с неконтролирана хипертония или сърдечно-съдови заболявания.
Черен дроб: Редки съобщения за преходно повишаване на чернодробните ензими; изключително редки съобщения за случаи предполагат възможно остро чернодробно увреждане, но не са чести.
Дългосрочна безопасност (разширено проучване)
52-седмично отворено разширено проучване установи трайни подобрения в желанието без нови основни сигнали за безопасност.
Дългосрочният профил на безопасност се счита за като цяло добре поносим, като основните проблеми с поносимостта все още са краткосрочните нежелани реакции като гадене.
Бележки за употреба на ключове
Одобрената популация е ограничена: Само за жени в пременопауза с придобита, генерализирана HSDD.
Не е широко одобрено за мъже (еректилната дисфункция или намаленото желание при мъжете все още са в процес на изследване).
Проверката за безопасност е от решаващо значение: преди предписване трябва да се направи оценка на хипертонията, сърдечно-съдовите заболявания и чернодробната анамнеза.
Бързо обобщение на данните
Одобрение от FDA: 2019 (Vyleesi).
Доза: 1,75 mg подкожна инжекция, при поискване.
Фармакокинетика: Tmax ~60 мин; t½ 2–3 ч; ефекти до ~16 ч.
Ефикасност (Фаза III, сборни данни):
FSFI-D: +0,35 (P<.001)
FSDS-DAO: −0,33 (P<.001)
Нежелани събития:
Гадене: до ~40%
Зачервяване: ≥10%
Главоболие: ≥10%
Наблюдава се преходно повишаване на кръвното налягане.
Сравнителна таблица и графика (обобщение)
| Тип изследване / данни | Крайна точка / Мярка | Стойност / Описание |
|---|---|---|
| Фаза III (301+302 обединени) | FSFI-D (област на желанията) | +0,35 спрямо плацебо (P<0,001); FSDS-DAO −0,33 |
| Нежелани събития | Гадене, зачервяване, главоболие | Гадене ~30–40% (макс. ~40%); зачервяване ≥10%; главоболие ≥10% |
Време на публикуване: 30 септември 2025 г.